Останнi новини
- Привітання з 8 Березня07.03.2025
- Компанія «Валартін Фарма» взяла участь у семінарі «Від нейронів до зору:…25.02.2025
- Компанія «Валартін Фарма» виступила партнером науково-практичної конференції…17.02.2025
- Компанія «Валартін Фарма» виступила партнером семінару «Сітківка: Інновації та…04.02.2025
- Препарати "Валартін Фарма" для здоров’я наших захисників20.01.2025
- З Різдвом Христовим та Новим роком!24.12.2024
Публікації
Результати застосування препарату «Альфапег®» в комплексній терапії хронічного вірусного гепатиту С (період 2013-2014 рр.)

Кафедра інфекційних хвороб
Львівського Національного медичного університету ім. Данила Галицького
Комунальний заклад Львівської обласної Ради
«Обласна клінічна інфекційна лікарня»
Науково-практична конференція “Актуальні питання гепатології»
24 жовтня 2014 року
Тези доповіді:
«Результати постреєстраційного клінічного моніторингу застосування препарату «Альфапег®»
в комплексній терапії хронічного вірусного гепатиту С (період 2013-2014 рр.)»
А.О.Семенов, ТОВ «Валартін Фарма»
ТОВ «Валартін Фарма» представляє результати постреєстраційного клінічного моніторингу застосування препарату «Альфапег®» в комплексній терапії хронічного вірусного гепатиту С при лікування 207 пацієнтів, що отримували комплексну терапію препаратом «Альфапег®» у 2013 – 2014 рр .
Відповідно до діючої у ТОВ «Валартін Фарма» процедури фармаконагляду за ефективністю та безпекою лікарських засобів, ТОВ «Валартін Фарма» як заявник медичного імунобіологічного препарату «Альфапег®» розробило та організувало комплекс заходів з активного фармаконагляду за безпекою та ефективністю застосування препарату у післяреєстраційний період (2013-2014 рр.).
В межах зазначених заходів активного фармаконагляду, ТОВ «Валартін Фарма» було розроблено та впроваджено відповідну операційну процедуру із постреєстраційного спостереження за перебігом та результатами застосування препарарату «Альфапег®» у пацієнтів, хворих на хронічний вірусний гепатит С, в основі яких було покладено спеціально запроваджені індивідуальні реєстраційні форми пацієнтів, що приймали участь в моніторингу.
Індивідуальні реєстраційні форми заповнювалися лікарями на кожного з 207 пацієнтів, щодо яких було зібрано та узагальнено дані про перебіг та результати терапії за період з листопада 2013 р. по жовтень 2014 р. Лікарі заносили до реєстраційної форми демографічну та клінічну інформацію про пацієнта, інформацію про схему лікування, його ефективність, відомості про переносимість препарату та побічні явища, тощо. Персональні дані про пацієнтів закодовані за допомогою ініціалів. Кожна форма підписана та засвідчена печаткою лікаря.
Усі пацієнти щодо яких представлені індивідуальні реєстраційні форми (207 пацієнтів) мають діагноз хронічного вірусного гепатиту С (ХВГС) з різними генотипами вірусу, отримують або отримували подвійну терапію вітчизняним пегільованим інтерфероном альфа-2b «Альфапег®» та рибавірином («Лівел») станом на жовтень 2014 року.
Під час обробки отриманих результатів постреєстраційного моніторингу, пацієнтів було розділено на 2 досліджувані групи. До першої групи увійшли 50 пацієнтів, які станом на жовтень 2014 року закінчили лікування препаратом «Альфапег®» та відповідали критеріям:
-пацієнти з вперше встановленим діагнозом ХВГС;
-пацієнти, які не отримували раніше терапію якими-небудь пегільованими або лінійними інтерферонами ;
-пацієнти отримали повний курс терапії пегінтерфероном альфа-2b («Альфапег®») і рибавірином (Лівел).
До другої досліджуваної групи увійшли 157 пацієнтів, які на жовтень 2014 року на тій чи іншій стадії проходять лікування препаратом «Альфапег®» та відповідають критеріям:
-пацієнти з вперше встановленим діагнозом ХВГС;
-пацієнти, які не отримували раніше терапію якими-небудь пегільованими або лінійними інтерферонами ;
-пацієнти, які зараз отримують курс терапії пегінтерфероном альфа-2b («Альфапег®») і рибавірином (Лівел).
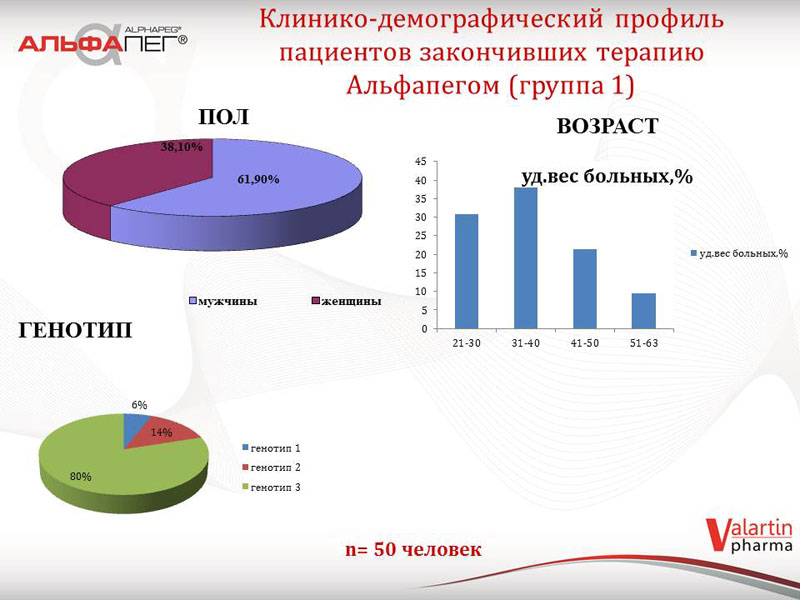
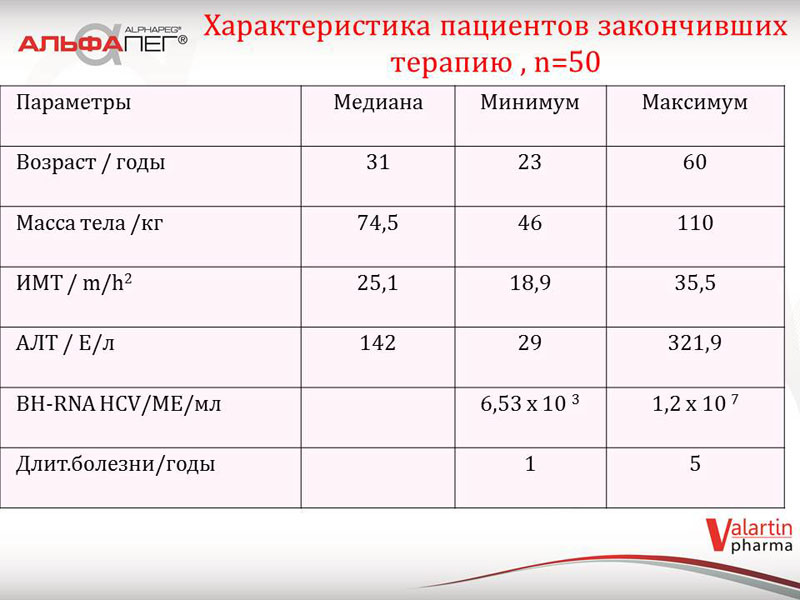
Клініко-демографічний профіль пацієнтів першої групи (закінчили терапію «Альфапегом®») був наступним: переважали пацієнти з 3-м генотипом ХВГС – 40 осіб (80%), 2-й генотип відзначався у 7 пацієнтів (14%), 1-й генотип – у 3-х пацієнтів (6%); переважали пацієнти чоловічої статі ніж жіночої (61,9% проти 38,9%); найбільше пацієнтів було з середнім віком від 30 до 40 років.
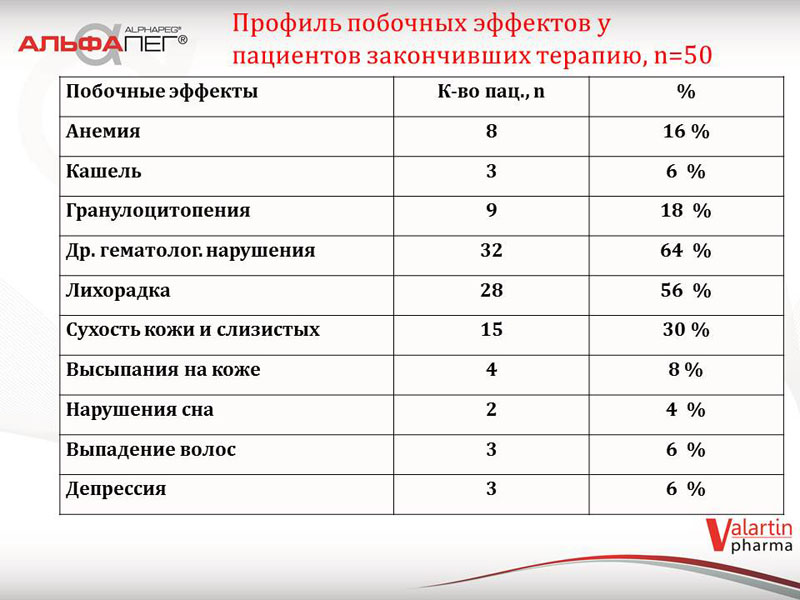
Профіль побічних ефектів у пацієнтів першої групи (закінчили терапію) був наступним: лихоманка спостерігалася у 28 пацієнтів (56%), сухість шкіри та слизових відмічалася у 15 пацієнтів (30%), шкіряні висипи у 4 пацієнтів (8%). Частота виникнення даних побічних реакцій вкладається в загальноприйнятну статистику виникнення подібних явищ, що виникають на терапії пегінтерферонами. Серед гематологічних порушень частіше зустрічалися гранулоцитопенія (18%) та анемія (16%). Представлені відхилення не вимагали зниження дози або відміни препарату.
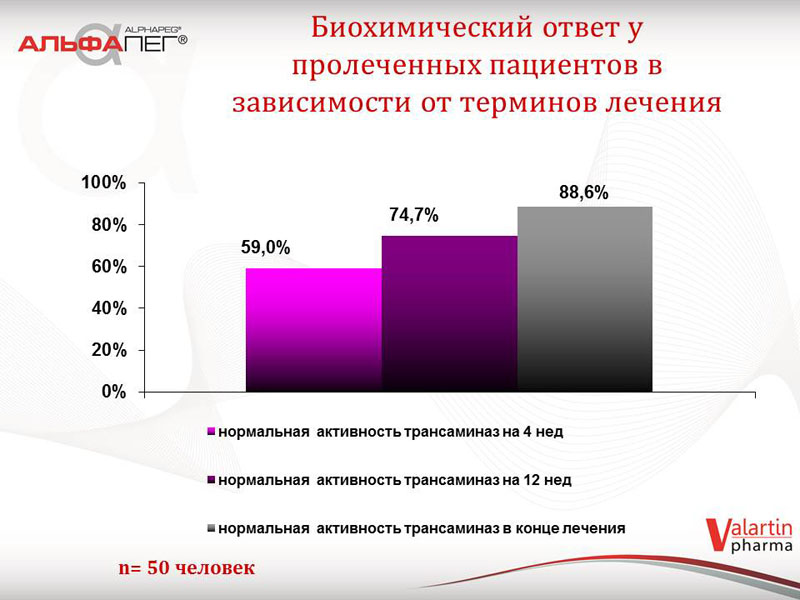
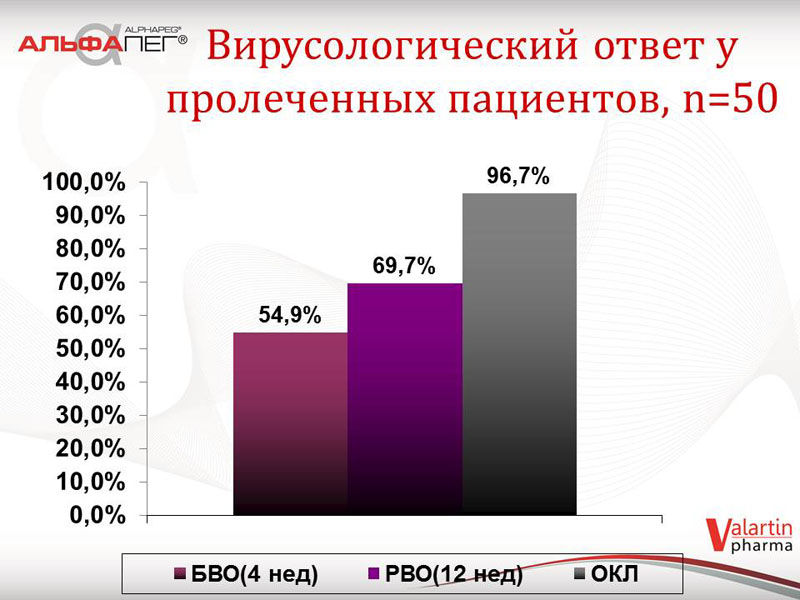
Також були зібрані дані щодо біохімічної відповіді у пацієнтів першої групи в залежності від термінів лікування. У 59 % пацієнтів відмічалася нормальна активність трансаміназ на 4 тижні, у 74,7 % пацієнтів на 12 тижні, у 88,6 % пацієнтів - у кінці лікування. Що стосується вірусологічної відповіді у пролікованих пацієнтів: швидка вірусологічна відповідь (ШВВ) відмічалась у 54,9 % пацієнтів, рання вірусологічна відповідь (РВВ) відмічалась у 69,7 % пацієнтів, відповідь в кінці лікування (ВКЛ) - 96,7 % пацієнтів.
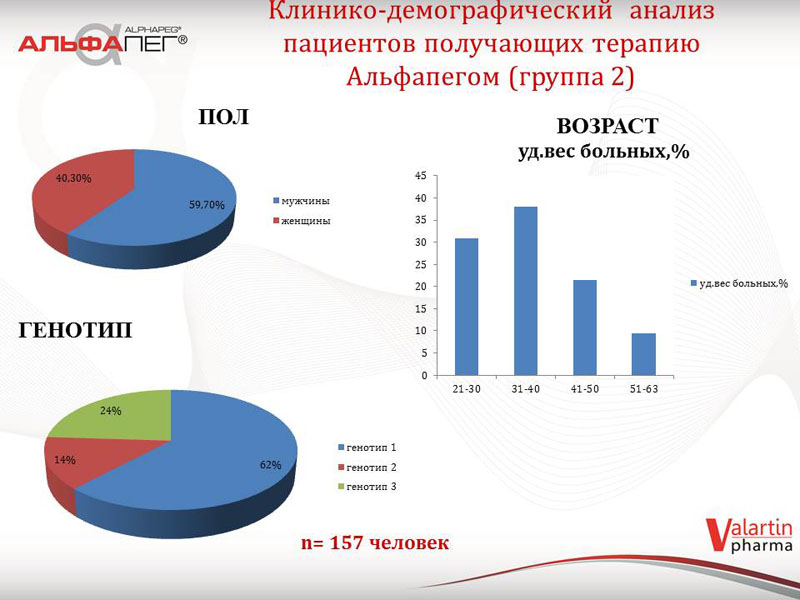
Клініко-демографічний профіль пацієнтів другої групи (знаходяться на терапії «Альфапегом®» станом на жовтень 2014 року) є наступним: переважають пацієнти з 1-м генотипом ХВГС – 98 осіб (62%), 2-й генотип ХВГС діагностовано у 21 пацієнтів (14%), 3-й генотип – у 38 пацієнтів (24%); переважають пацієнти чоловічої статі, ніж жіночої (59,7 % проти 40,3 % відповідно); найбільше пацієнтів середнього віку - від 30 до 40 років.
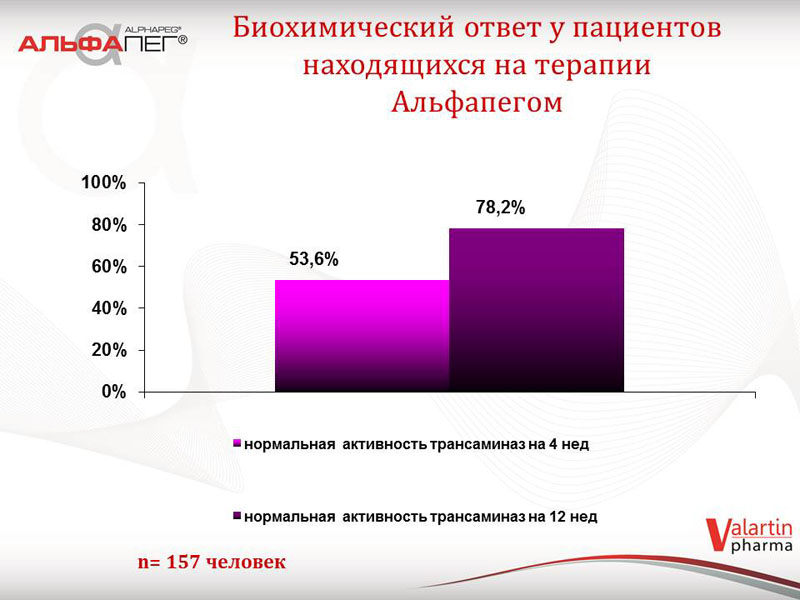
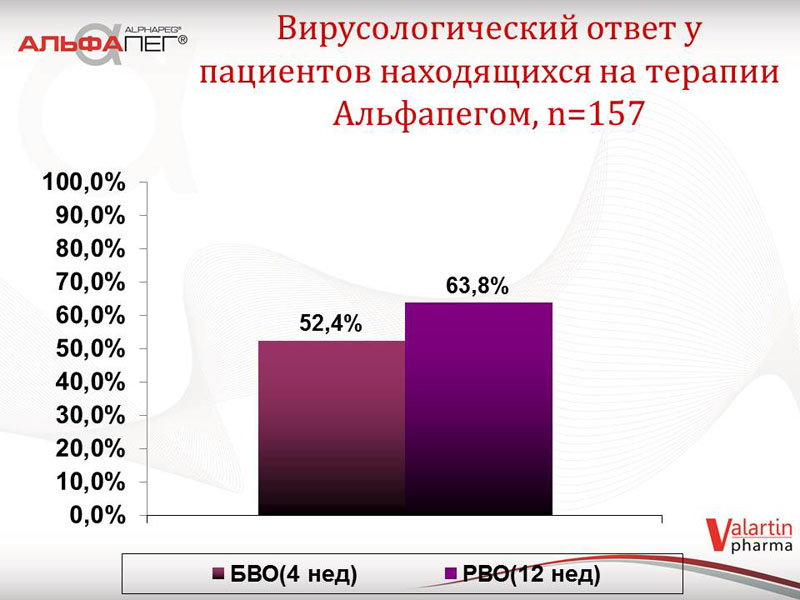
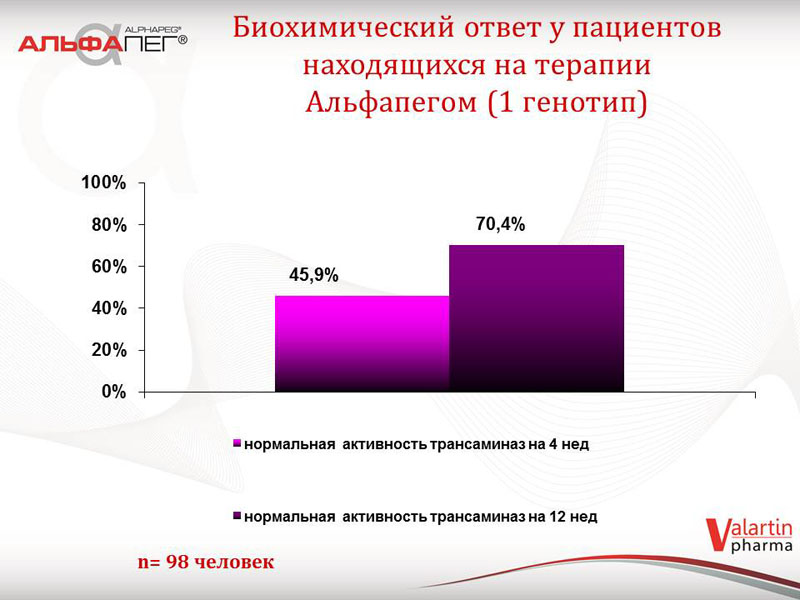
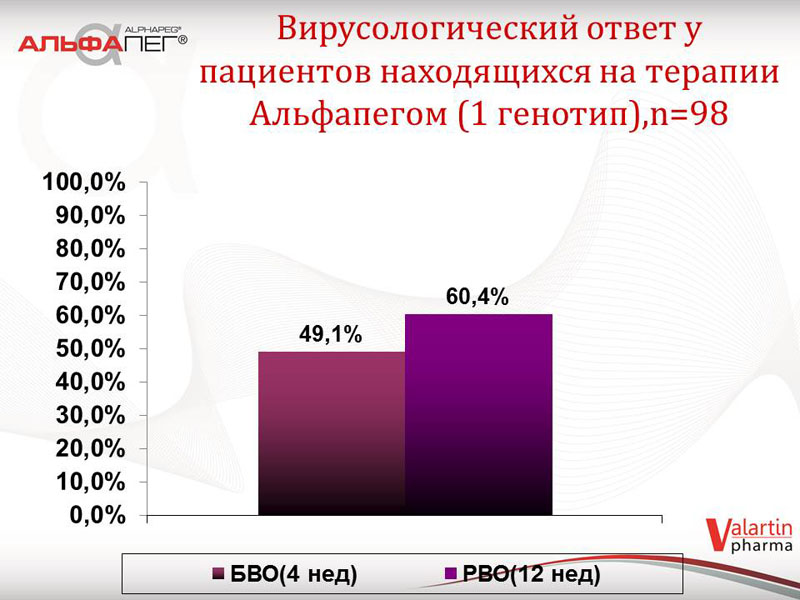
Проаналізовані дані щодо біохімічної відповіді на лікування препаратом «Альфапег®» у пацієнтів другої групи (станом на жовтень 2014 року), в залежності від термінів лікування. У 53,6 % пацієнтів відмічається нормальна активність трансаміназ на 4 тижні, у 78,2 % пацієнтів - на 12 тижні. Серед пацієнтів з 1-м генотипом ХВГС (98 хворих) зазначені показники складають відповідно 45,9 % та 70,4 %. Що стосується вірусологічної відповіді у пацієнтів, які зараз знаходяться на терапії: швидка вірусологічна відповідь (ШВВ) відмічається у 52,4 % пацієнтів, рання вірусологічна відповідь (РВВ) - у 63,8 % пацієнтів. Серед пацієнтів з 1-м генотипом ХВГС зазначені показники складають 49,1 % та 60,4 % відповідно. Отримані показники ранньої та швидкої вірусологічної відповіді у цих хворих свідчать про сприятливий прогноз терапії.
Таким чином, за підсумками оцінки отриманих результатів постреєстраційного клінічного моніторингу застосування препарату «Альфапег®» в комплексній терапії хронічного вірусного гепатиту С (період 2013-2014 р.р.), які були зібрані при лікуванні 207 пацієнтів, що отримували комплексну терапію препаратом «Альфапег®» у 2013 – 2014 рр., встановлено:
- дані постреєстраційного клінічного моніторингу підтверджують високий рівень ефективності та безпеки препарату «Альфапег®» при лікуванні пацієнтів, що завершили терапію (50 хворих);
- частота побічних явищ та гематологічних порушень у пролікованих пацієнтів вкладається у загальноприйняту статистику терапії пегінтерферонми і не вимагала зниження дози або відміни препарату;
- за результатами аналізу первинних реєстраційних форм 157 хворих, що станом на жовтень 2014 року перебували на комплексній терапії препаратом «Альфапег®» (з них 98 осіб мають 1-й генотип ХГВС), у понад 50% хворих відзначається швидка вірусологічна відповідь, а у понад 60% - рання вірусологічна відповідь, що свідчить про позитивний прогноз терапії.